 |
| Ёу МПЦЎИЎПТРЧ ФкЗЮГЊ19 ФЁЗсСІ МГИэ. (УтУГ= МПЦЎИЎПТ) |
ЁМАЧАДйРЬСІНКЦЎ | РЬСЄШё БтРкЁН НФЧАРЧОрЧАОШРќУГДТ ЂпМПЦЎИЎПТРЧ ФкЗЮГЊ19 ФЁЗсСІ ‘ЗКХАЗЮГЊСж960mg(ЗЙБзДмКёИП)РЬ ЧАИёЧуАЁ НХУЛРЛ СЂМіЧдПЁ ЕћЖѓ ЧтШФ ЧуАЁ АњСЄПЁ ДыЧи ДйРНАњ ААРЬ МГИэЧпДй.
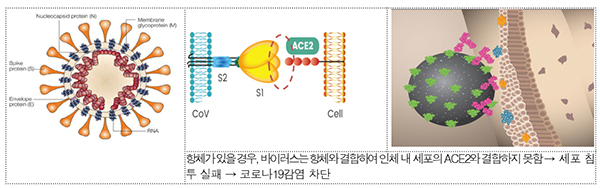
‘ЗКХАЗЮГЊСж’ДТ ЂпМПЦЎИЎПТПЁМ НХОрРИЗЮ АГЙп СпРЮ РЏРќРкРчСЖЧе СпШЧзУМ ФЁЗсСІДй. СжМККаРК ЗЙБзДмКёИП(Regdanvimab)РЬЖѓДТ БЙСІРЯЙнИэРЛ КЮПЉЙоРК ФкЗЮГЊ19 СпШЧзУМДй.
ФкЗЮГЊ19 ПЯФЁРкРЧ ЧїОзПЁ СИРчЧЯДТ СпШЧзУМ РЏРќРкИІ МБКАЧЯАэ МБКА·УЄУыЧб РЏРќРкИІ ДыЗЎ Л§ЛъРЬ АЁДЩЧб МїСж ММЦїПЁ Л№РдЧи ММЦї ЙшОч АњСЄРЛ ХыЧи ДыЗЎРИЗЮ Л§ЛъЧбДй.
ЕћЖѓМ ФкЗЮГЊ19 ПЯФЁРкРЧ ЧїОзПЁМ ЧзУМИІ СіМгРћРИЗЮ УЄУыЧв ЧЪПфОјРЬ РЏРќРк РчСЖЧеЕШ ММЦїИІ РЬПыЧи СпШЧзУМИІ ДыЗЎ Л§ЛъЧв Мі РжДй.
БтСИПЁ ФЁЗсСІЗЮ ЧуАЁЧб 'КЃХЌЗчИЎСж(ЗНЕЅНУКёИЃ)'ДТ ММЦї ГЛ АЈПАЕШ ФкЗЮГЊ19 ЙйРЬЗЏНК КЙСІИІ ОяСІЧЯДТ ЙнИщ, ‘ЗКХАЗЮГЊСж(ЗЙБзДмКёИП)’ДТ ФкЗЮГЊ19 ЙйРЬЗЏНКРЧ ЧЅИщПЁ РжДТ РЮУМ ММЦї АсЧе КЮРЇПЁ ЧзУМФЁЗсСІАЁ ДыНХ АсЧеЧдРИЗЮНс ЙйРЬЗЏНКАЁ ММЦї ГЛЗЮ ФЇХѕЧЯДТ АЭРЛ ИЗДТ АЭРЬДй.
‘ЗКХАЗЮГЊСж’РЧ ПЙЛѓ ДыЛѓШЏРкДТ АцСѕКЮХЭ СпЕюСѕБюСіРЧ ФкЗЮГЊ19 ШЏРкДй. ПЙЛѓ ПыЙ§Ањ СІЧќРК 90КаАЃ СЄИЦХѕПЉЧЯДТ СжЛчСІЗЮ, ПЙЛѓ ШПДЩ‧ШПАњДТ АцСѕ~СпЕюСѕ ФкЗЮГЊ19 ШЏРкРЧ ФЁЗсДй.
НФОрУГДТ СіГ 2Пљ АГЙп УЪБтКЮХЭ ЧуАЁНХУЛБюСі СІСЖЛчПЭ ЙаСЂЧб ЛѓДуРЛ ХыЧи РгЛѓ 2Лѓ БтАЃРЛ 10АГПљЗЮ ДыЦј ДмУрЧи ПЯЗсЧпДй.
РгЛѓНУЧшПЁ РжОюМДТ ХНЛіРћ РЧЙЬПЭ ФЁЗсРћ ШПАњИІ ЧдВВ ШЎРЮЧв Мі РжДТ 2Лѓ РгЛѓНУЧш МГАшАЁ ЕЩ Мі РжЕЕЗЯ ДыЛѓ ШЏРк ШЎДы БЧАэ, РќЙЎАЁ РкЙЎ ЕюРЛ СіПјЧпДй.
МПЦЎИЎПТРК НФОрУГЗЮКЮХЭ 2ЛѓАњ 3ЛѓРЛ ЕПНУПЁ НТРЮЙоРК ДйБЙАЁ РгЛѓНУЧш Сп 2ЛѓРЛ ПЯЗсЧЯАэ ЧуАЁИІ НХУЛЧЯДТ АЭРИЗЮ, 3ЛѓРК РЬЙј ЧуАЁНХУЛАњ АќАш ОјРЬ АшШЙДыЗЮ СјЧрЧв ПЙСЄРЬДй.
2ЛѓРК АцСѕ~СпЕюСѕРЧ ФкЗЮГЊ19 ШЏРк 327ИэРЛ ДыЛѓРИЗЮ ЙпП Ею 7АЁСі ФкЗЮГЊ19 СѕЛѓПЁ ДыЧб ШИКЙ БтАЃ ДмУрАњ ЙйРЬЗЏНК АЫЛч НУ ОчМКПЁМ РНМКРИЗЮ РќШЏЧЯДТ ЕЅ АЩИЎДТ БтАЃ ДмУрРЛ ШЎРЮЧЯДТ АЭРЛ ИёЧЅЗЮ ЧпДй.
3ЛѓРК АцСѕ~СпЕюСѕРЧ ФкЗЮГЊ19 ШЏРк 720ИэРЛ ДыЛѓРИЗЮ ЛъМв ФЁЗсАЁ ЧЪПфЧЯАХГЊ РдПјЧЯДТ Ею СѕЛѓ ОЧШ КёРВРЬ АЈМвЧЯДТСі ШЎРЮЧЯДТ АЭРЛ АшШЙЧЯАэ РжДй.
МПЦЎИЎПТРЬ РЬЙј ФЁЗсСІ ЧуАЁ·НЩЛчПЁ СІУтЧб РкЗсДТ УЗДмСІЧАЧуАЁДуДчАќПЁМ ПЙКёНЩЛчЧб ШФ, ЙЬИЎ БИМКЕШ ‘ФкЗЮГЊ19 ЙщНХ·ФЁЗсСІ ЧуАЁРќДуНЩЛчЦР’РЧ КаОпКА РќЙЎАЁАЁ КёРгЛѓ, РгЛѓ, ЧАСњ Ею ЧуАЁПЁ ЧЪПфЧб РкЗсПЁ ДыЧи НЩЛчЧв ПЙСЄРЬДй.
РЬШФ НЩЛч РЧАпРЛ СОЧеЧи ЧуАЁ ХИДчМКРЛ ЦЧДмЧЯАэ, ПмКЮ РќЙЎАЁЗЮ БИМКЧб СпОгОрЛчНЩРЧРЇПјШИ РкЙЎ ЕюРЛ АХУФ УжСО ЧуАЁЧЯДТ МјМДй.
НФОрУГ АќАшРкДТ "ОШРќЧЯАэ ШПАњ РжДТ ФкЗЮГЊ19 ФЁЗсСІИІ ЛчПыЧв Мі РжЕЕЗЯ ‘ФкЗЮГЊ19 ЙщНХ·ФЁЗсСІ ЧуАЁРќДуНЩЛчЦР’РЧ КаОпКА РќЙЎАЁПЭ ПмКЮ РќЙЎАЁ ЕюРЛ ШАПыЧи ОШРќМК‧ШПАњМКРЛ УЖРњШї АЫСѕЧЯАкДй"Аэ РќЧпДй.
НФОрУГДТ РЬЙј ЧуАЁНХУЛ СІЧАРЛ КёЗдЧЯПЉ ФкЗЮГЊ19 ЙщНХ‧ФЁЗсСІРЧ НХМгЧб ЧуАЁ·НЩЛчИІ РЇЧи БтСИ УГИЎБтАЃ(180РЯ РЬЛѓ)РЛ ДмУрЧи 40РЯ РЬГЛПЁ УГИЎЧЯДТ АЭРЛ ИёЧЅЗЮ ЧЯАэ РжДй.
РЬСЄШё БтРк kunkang1983@naver.com
<РњРлБЧРк © АЧАДйРЬСІНКЦЎ РЮХЭГнЦЧ, ЙЋДм РќРч Йз РчЙшЦї БнСі>
#МПЦЎИЎПТ#ФкЗЮГЊ#ФкЗЮГЊ19#ЗКХАЗЮГЊСж#ФкЗЮГЊФЁЗсСІ#НФОрУГ#НФЧАРЧОрЧАОШРќУГ#АЧАДйРЬСІНКЦЎ

![[4Пљ ЦЏС§] ГЛ ИіПЁ ЙпКйРЬСі ИјЧЯАдЁІСЖБтПЁ ОЯ ПЙЙцЙ§](/news/photo/202404/39838_32395_2841.jpg) [4Пљ ЦЏС§] ГЛ ИіПЁ ЙпКйРЬСі ИјЧЯАдЁІСЖБтПЁ ОЯ ПЙЙцЙ§
[4Пљ ЦЏС§] ГЛ ИіПЁ ЙпКйРЬСі ИјЧЯАдЁІСЖБтПЁ ОЯ ПЙЙцЙ§
![[БшБЄМіРЧ ФЁОЦНУХЉИД] ОЦИЛАЈ МвИъРЬ ОШХИБюПю РЬРЏ](/news/thumbnail/202404/39860_32421_4530_v150.jpg)